COVID19 e patentes – considerações sobre a relevância de superar barreiras de patentes e garantir acesso a medicamentos
Francisco Viegas Neves da Silva
Advogado. Mestre em Direito pela UFSC. Bacharel em Direito pela UCPEL. Consultor de Policy Advocacy da DNDi- Iniciativa Medicamentos para Doenças Negligenciadas. Pesquisador do GEDAI. https://twitter.com/franciscoA2M
Revisor: Marcos Wachowicz
- A capacidade da ciência e tecnologia para atender os desafios
A pandemia da Covid-19[1] declarada, em 11 de março, pela Organização Mundial de Saúde, apresenta impactos sem precedentes no mundo moderno, especialmente pela conformação geopolítica de maior globalização e densidade demográfica, a qual possibilitou o seu rápido crescimento e proliferação.
Diante deste desafio global, em particular de saúde pública, e por tratar-se de um vírus completamente novo para a saúde humana, de rápida propagação, com significativa letalidade, cuja ação e respectiva resposta imune ainda pouco se conhece, tornou-se ainda mais necessária uma rápida resposta da ciência.
Importantes medidas foram adotadas no início da epidemia, para rapidamente compartilhar o primeiro sequenciamento do SARs-CoV2[2] com a comunidade científica mundial, o que permitiu uma compreensão global mais acelerada sobre o vírus e também estudos subsequentes para o desenvolvimento de diagnósticos, medicamentos e vacinas, num esforço global.
No Brasil, a prévia experiência com zika e dengue somada com a expertise de pesquisadores nacionais permitiu, em 48h, sequenciar o vírus que afetou o primeiro paciente no país. Tal fato reforça a necessidade de uma forte capacidade e estrutura de ciência e tecnologia nacional para atender os desafios aqui enfrentados. Posteriormente, com o avanço na compreensão do funcionamento do vírus diversos ensaios clínicos começaram a ser realizados para testar medicamentos e vacinas para o tratamento e prevenção da COVID-19.
Após essas considerações preliminares, cumpre destacar que o presente artigo foca em realizar uma breve reflexão do cenário dos medicamentos que estão sendo testados para o enfrentamento da COVID-19 e quais os riscos que a proteção patentária desses produtos representa sobre o interesse da saúde publica.
- O processo de desenvolvimento de novos medicamentos
Antes de avançar sobre as interfaces entre as potenciais barreiras de propriedade intelectual e a sua repercussão para o acesso a medicamentos, cabe apresentar esclarecimentos iniciais sobre como ocorre a pesquisa e desenvolvimento de medicamentos.
Usualmente o desenvolvimento de um novo medicamento passa por um período longo de pesquisa em laboratório, testes em animais, testes em humanos e, por fim, se a droga cumpre com os requisitos de segurança, qualidade e eficácia para uso em seres humanos é requerido o registro sanitário, no caso do Brasil na ANVISA, daquele medicamento para a indicação na qual foi testada. Abaixo uma ilustração da DNDi – Iniciativa Medicamentos para Doenças Negligenciadas[3] apresenta detalhes de cada fase da pesquisa, seu objetivo, taxa de falha e também período máximo de duração que pode ser, usualmente, de até 16 anos.

Pelos motivos acima expostos ,diante da urgência de se encontrar um medicamento que seja capaz de enfrentar a COVID-19 rapidamente a estratégia de muitos centros de pesquisa tem sido de testar medicamentos já conhecidos e aprovados para outras doenças, ou seja, que já tem seu perfil de segurança e qualidade atestado pelas agências regulatórias sendo suficiente comprovar a sua eficácia para outra doença (COVID-19). Ou seja, a estratégia de pesquisa busca encurtar significativamente o tempo de pesquisa e identificar uma nova indicação (uso) de um medicamento já conhecido. Para o tema de patentes de segundo uso essa discussão é muito importante, como se verá a seguir.
- Iniciativas globais para o desenvolvimento de medicamentos são lançadas
A Organização Mundial da Saúde (OMS), em 18 de março, apenas 7 dias após declarar a COVID-19 uma pandemia, anunciou que após a revisão de pesquisas e evidências disponíveis por parte de especialistas iria lançar um estudo em vários países denominado Solidariedade[4]. Tal estudo visa testar a eficácia, baseado em um protocolo de pesquisa harmonizado e coordenado, constituído por cinco opções de tratamento para o enfrentamento da COVID-19.
Na ocasião do lançamento da iniciativa havia 10 países envolvidos, sendo progressivamente incluídos mais interessados, atingindo atualmente o número de 70 países, dentre eles o Brasil (por meio da FIOCRUZ). A expectativa da OMS é que um estudo multicêntrico possa acelerar em até 80% a identificação de um tratamento eficaz para a COVID-19. Os esquemas terapêuticos sendo testados são:
- Remdesevir – medicamento novo que foi previamente testado para Ebola. Apresentou resultados promissores em estudos em animais para MERS-CoV e para SARS, também causados por coronavírus, que sugere uma potencial eficácia para COVID-19;
- Lopinavir/Ritonavir – medicamento conhecido que compõe o tratamento de pessoas vivendo com HIV/Aids. Alguma evidência laboratorial sugere que pode ser um tratamento útil para COVID-19, MERS e SARS, falta comprovação clínica ou de prevenção da infecção. Estudo visa confirmar benefício para pacientes afetados pela COVID-19
- Interferon beta-1a – medicamento conhecido e usado para o tratamento de esclerose múltipla.
- Cloroquina e hydroxicloroquina – medicamentos já utilizados para o tratamento da malária e doenças reumáticas, respectivamente. Na China e na França pequenos estudos indicaram um possível benefício do fosfato de cloroquina para o tratamento da pneumonia causada pela COVID-19, mas precisa de confirmação por meio de ensaios clínicos randomizados.
A liderança cientifica e técnica da OMS no desenvolvimento do “Solidariedade” tem sido ímpar. Além disso, diversos autores publicaram, no dia 02 de abril, um chamado para a formação de uma Coalisão de Pesquisa Clínica para o COVID-19[5], publicado na revista The Lancet[6], diante da constatação de que dos mais de 600 ensaios clínicos em curso, poucos estão sendo realizados em países com sistemas de saúde menos resilientes. Essa coalisão é conformada por especialistas, ministros de saúde, acadêmicos, sociedade civil e organizações de pesquisa e desenvolvimento. Um de seus principais objetivos é uma maior coordenação entre as pesquisas, compartilhamento de dados e priorização de iniciativas para populações e sistemas de saúde mais vulneráveis, assim como que se consolide o compromisso politico internacional para que os medicamentos desenvolvidos nas referidas pesquisas sejam considerados como bens públicos e estejam disponíveis para a população a preços acessíveis e sem barreiras de patentes. Organizações sem-fins lucrativos de P&D como a DNDi[7], que compõem a referida coalisão, apresentam como política e modelo alternativo de pesquisa a garantia de preços acessíveis dos medicamentos desde o início do desenvolvimento e não somente ao final. Tal princípio pode e necessita ser adotado mais amplamente e capitaneado pela OMS, particularmente diante da presente pandemia.
Abaixo pode-se encontrar parte da informação recentemente disponibilizada, em 27 de março, pelo Observatório de Tecnologias relacionadas a COVID-19 do INPI (Instituto Nacional de Propriedade Industrial), em que relaciona os principais fármacos sendo testados atualmente. A plataforma lançada pelo INPI também apresenta notícias relacionadas a vacinas, respiradores sendo desenvolvidos, fontes de financiamento e relação dos 17 testes de diagnostico registrados na ANVISA e informações sobre vacinas e fontes de financiamento.
FÁRMACOS EM FASE DE TESTES CLÍNICOS PARA TRATAMENTO DE PNEUMONIA POR COVID-19[8]
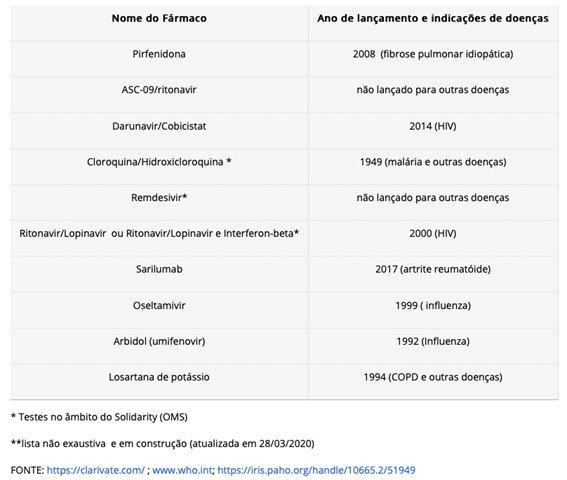
Analisando a tabela acima pode-se verificar que há em testes muitos medicamentos já conhecidos, mas vários deles possivelmente são também cobertos por pedidos de patente, assim como há novas entidades químicas (novos medicamentos) como o Remdesvir e o ASC-09/Ritonavir.
A preocupação com as barreiras de propriedade intelectual advém do fato de que a disponibilidade de tecnologias de saúde pode ser limitada pelos direitos exclusivos de comercialização conferidos ao titular da patente por 20 anos desde a data do protocolo do pedido de patente no INPI. As patentes concedem direitos de exclusividade de fornecimento de um produto, limitando a oferta e impossibilitando a concorrência, ocasionando assim preços elevados por uma escassez e falta de competição artificial, decorrente do monopólio concedido.
Outro elemento que merece uma maior reflexão é a ausência/dificuldade de disponibilização até o momento[9] pelo INPI, órgão que recebe e examina todos os pedidos de patentes de fármacos no Brasil, da informação a respeito das patentes solicitadas ou concedidas para os medicamentos, kits de diagnostico e equipamentos médicos (respiradores) vitais para o enfrentamento da COVID-19. Tal lacuna de informação pode servir para corroborar a falta de transparência e dificuldade de identificação da relação entre as patentes existentes e as tecnologias no mercado. Considerando que o próprio órgão de exame de patentes possui dificuldade em identificar e tornar pública tal informação, torna-se necessária uma reflexão urgente acerca da qualidade e especificidade da informação contida e exigida dos depositantes nos pedidos de patentes, bem como sua divulgação mais clara para a sociedade e o setor produtivo. Exemplificando, questiona-se como um produtor poderá oferecer sua capacidade de fabricar respiradores ao país, sem ter o conhecimento da existência de alguma patente bloqueando o seu produto.
O mesmo pode ser dito sobre o fornecimento de um medicamento genérico ou insumo de diagnóstico. Por outro lado, como podem a sociedade e o domínio público se beneficiar da “revelação da tecnologia” que o depositante da patente faz, em busca da obtenção do monopólio (patente), se a informação tecnológica não é facilmente acessível.
Considerando que o Ministério da Economia está realizando Oficinas para o desenvolvimento de uma Estratégia Nacional de Propriedade Intelectual, certamente a suficiência descritiva dos pedidos de patente, com uma mais clara identificação de que patentes/tecnologias se relacionam a cada produto no mercado, particularmente em caso de emergência nacional, é um dos pontos que merece atenção especial. Tal medida visa garantir maior equilíbrio ao sistema de patente ao tornar de forma mais clara a divulgação das tecnologias e seu status patentário.
Importante recordar que o Brasil, até o advento da atual Lei de Propriedade Industrial (em 1996), no não concedia patentes para produtos farmacêuticos (somente para processos de fabricação) e foi somente com o Acordo da OMC sobre Aspectos dos Direitos de Propriedade Intelectual Relacionados com o Comércio (TRIPS), que os países que passaram a compor a organização foram obrigados a proteger produtos farmacêuticos.
Na prática, na área da saúde, temos visto recentemente a priorização de tratamentos somente para pacientes em estado mais grave de saúde, portanto, não proporcionando o acesso a todos que necessitam de tratamento diante de preços proibitivos dos tratamentos cobrados pelas detentoras de patentes. Trata-se do caso dos medicamentos para hepatite C que, em particular quando foram lançados e não havia competição genérica, possuíam preços tão altos que somente pacientes com elevado grau de doença hepática e quase com quadro de transplante que recebiam a medicação, pois os preços ameaçavam a sustentabilidade do Sistema Único de Saúde e impossibilitavam a capacidade do Ministério da Saúde de proporcionar acesso igualitário à população.
Para superar tais barreiras existem flexibilidades no sistema de propriedade intelectual, que os países podem e devem utilizar para salvaguardar a saúde pública. Trata-se da Licença Compulsória, uma medida que permite que o mesmo Estado que concedeu o monopólio de uso da tecnologia o suspenda, mediante o pagamento de uma indenização, para que a tecnologia possa ser utilizada por outros, seja em prol do interesse público, como sanção por abuso de direito econômico, para uso governamental ou para a proteção da saúde pública, etc. Seria semelhante ao instituto da desapropriação de uma propriedade que não seja intelectual.
As hipóteses, como visto acima, de declaração e uso de licenças compulsórias não estão circunscritas a situações de emergências, mas devem ser ainda mais utilizadas em estas situações diante da primazia da saúde publica e da proteção da população sobre interesses comerciais.
Neste diapasão a Declaração de Doha sobre TRIPS e Saúde Pública da OMC corrobora que “o Acordo TRIPS não impede e não deve impedir que os Membros adotem medidas de proteção à saúde pública” assim como destaca que “o Acordo pode e deve ser interpretado e implementado de modo a implicar apoio ao direito dos Membros da OMC de proteger a saúde pública e, em particular, de promover o acesso de todos aos medicamentos”. A Declaração de Doha ainda destaca que “Cada Membro tem o direito de conceder licenças compulsórias, bem como liberdade para determinar as bases em que tais licenças são concedidas”, assim como “Cada Membro tem o direito de determinar o que constitui emergência nacional ou outras circunstâncias de extrema urgência, subentendendo-se que crises de saúde pública, inclusive as relacionadas com o HIV/AIDS, com a tuberculose, malária e outras epidemias, são passíveis de constituir emergência nacional ou circunstâncias de extrema urgência.”
Importante recordar que até hoje o Brasil somente utilizou uma vez a licença compulsória, em 2007, para o medicamento Efavirenz utilizado para o tratamento do HIV/Aids que, por possibilitar a importação de versões genéricas produzidas na Índia e, posteriormente, com a produção pública em Farmanguinhos possibilitou uma economia de mais de USD 94 milhões[10].
Destaca-se que geralmente não há somente um pedido de patente por medicamento.
Existem estudos que apontam uma miríade de patentes protegendo o mesmo composto, seu processo de produção, uso, apresentação, etc; prologando, assim, o período de exclusividade da proteção, muito além do período de 20 anos a partir do depósito da primeira patente submetida.
Se analisarmos o cenário de um novo medicamento sendo testado para COVID-19 como o Remdesevir, desenvolvido pela Gilead Sciences, há, de acordo com a base de dados da Medspal[11], três pedidos de patentes depositados (outros devem estar em período de sigilo) e sua data de expiração será entre 2029 e 2031, a depender de quais pedidos de patente sejam concedidos.
Por outro lado, se analisarmos o Lopinavir/Ritonavir que é um medicamento já registrado desde 2000 para HIV/AIDS (formulação em cápsula mole) e em 2005 (formulação termo-estável) há pelo menos, até hoje, há patentes que expiraram em 2017 e ainda há patentes com litigio na justiça que, se for concedida em favor do depositante, terá validade até 2026.
Estes são somente dois cenários, que ilustram bem como as patentes podem representar uma barreira a longo prazo, para o fornecimento de versões genéricas mais acessíveis para a população, necessidade que é ainda mais urgente em caso de uma pandemia e recursos públicos escassos.
Os exemplos acima ilustram bem a necessidade de adoção de licença compulsória, para a garantia do acesso a esses e quaisquer tratamentos que sejam identificados para o tratamento da COVID-19.
Outro cenário que também merece uma análise detida são as patentes de segundo uso médico. Como observou-se acima, alguns medicamentos sendo testados já possuem indicações estabelecidas para outras enfermidades.
No entanto, há países que incluíram nas suas legislações nacionais, muitas vezes por compromissos advindos de Acordos de Livre Comércio, a obrigação de concessão de patentes para segundos usos de medicamentos já conhecidos. Ou seja, além dos 20 anos de monopólio já concedidos para a molécula inicial, seria concedido outro monopólio de 20 anos pelo simples fato de se verificar, num ensaio clínico ou prática clínica, que aquela molécula serve também para o tratamento de outra enfermidade.
Na doutrina há diversas críticas à essa proteção adicional, pois apesar de poder representar uma importante descoberta terapêutica ela não cumpriria com os requisitos de patenteabilidade, notadamente de novidade, atividade inventiva e aplicação industrial. Países como a Argentina incluem na sua Guia de Exame de Patenteabilidade a vedação de concessão de patentes para segundos usos.
No Brasil não há proibição legal ao segundo uso de patentes, apesar de existir projeto de lei (PL 5403/2013) que visa qualificar como não patenteável e que há anos tramita na Câmara de Deputados por falta de iniciativa legislativa, mesmo sabendo-se que é o Estado quem acaba arcando com este ônus.
Por outro lado, a Diretriz de Exame do INPI não é clara em relação à vedação de reinvindicações de patentes, que contemplem o segundo uso de uma molécula já conhecida, acarretando um grande risco de uma retirada do domínio publico destes medicamentos, não só no País, mas em diversas jurisdições possa representar uma barreira para o acesso aos futuros tratamentos para a COVID-19.
A questão de acesso a medicamentos e insumos de saúde para o enfrentamento do COVID19 não é um desafio simples. A licença compulsória e a garantia de que não sejam concedidas patentes de segundo uso são ferramentas essenciais em um arsenal de medidas que devem ser adotadas para a garantia do acesso a tratamentos para a COVID-19. Além do desafio das barreiras de patente há questionamentos imediatos sobre a capacidade da indústria farmacêutica de, na conformação atual, dar conta da demanda de insumos e materiais de saúde e medicamentos para a proteção da população e dos profissionais de saúde. Assim como há a legitima preocupação dos pacientes, que atualmente fazem uso das medicações acima listadas de que o medicamento, muitas vezes de uso contínuo, que fazem uso diariamente seja direcionado para atender a demanda da COVID e falte para eles.
E, por último, encerro este breve artigo com uma reflexão essencial. Optaremos como coletividade por nos calar ou faremos valer a primazia da vida humana e da saúde acima dos interesses comerciais? Pensaremos na coletividade e em prol do bem comum ou da manutenção do status quo? Quais serão os valores e atitudes que serão a marca da resposta nacional e mundial à essa pandemia? Como coletivamente gostaríamos que a história da humanidade julgue a nossa sociedade ao analisar as posições tomadas nesse período dramático da civilização humana? Será um novo Holocausto em que as futuras gerações se perguntarão como foi possível que fossem feitas escolhas tão drásticas e erradas, ou será um momento em que a humanidade provará o seu valor com a primazia do coletivo sobre o individual?
[1] COVID-19 é a doença causa pelo vírus.
[2] SARS-CoV2 é o vírus causador da doença.
[3] DNDi – Innovación y acceso para poblaciónes desatendidas. Disponível em https://www.dndi.org/wp-content/uploads/2018/09/DNDi_innovacion-y-acceso-para-poblaciones-desatendidas.pdf Acesso em: 05/04/2020
[4] OMS. “Solidarity” Clinical Trial for COVID-19 treatments. Disponível em: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-clinical-trial-for-covid-19-treatments Acesso em: 05/04/2020
[5] https://covid19crc.org
[6]. Global coalition to accelerate COVID-19 clinical research in resource-limited settings. The Lancet. Disponível em: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)30798-4/fulltext#articleInformation Acesso em: 05/04/2020.
[7] DNDi. 15 years of Needs-Driven Innovation for Access: Key lessons, challenges, and opportunities for the future. Disponível em: https://www.dndi.org/wp-content/uploads/2019/10/DNDi_ModelPaper_2019.pdf Acesso em: 05/04/2020.
[8] INPI. Observatório de Tecnologias relacionadas ao COVID-19. Disponível em: http://www.inpi.gov.br/menu-servicos/patente/tecnologias-para-covid-19/MEDICAMENTOS%20 Acesso em: 05/04/2020.
[9] Presente artigo foi finalizado no dia 05 de abril.
[10] Viegas Neves da Silva, Francisco ; et al. Compulsory License and access to medicines: economic savings of Efavirenz in Brazil (2012). Oral presentation at the XIX International AIDS Conference, Washington, 2012. In: Abstract book of XIX International AIDS Conference.
[11] www.medspal.org







Trackbacks/Pingbacks